- Ascolta il nostro podcast
La terapia genica prodotta da Novartis per l’atrofia muscolare spinale (SMA) è una realtà anche in Italia. Il 9 marzo, infatti, l’Agenzia Italiana del Farmaco (AIFA) ha approvato e concesso l’erogazione gratuita a carico interamente del SSN per il farmaco onasemnogene abeparvovec (noto con il nome commerciale Zolgensma) per i pazienti:
- Affetti da SMA di tipo 1 fino a 13,5 kg
- Pazienti pre-sintomatici con 2 copie del gene SMN2.
La somministrazione si effettua con un’unica dose.
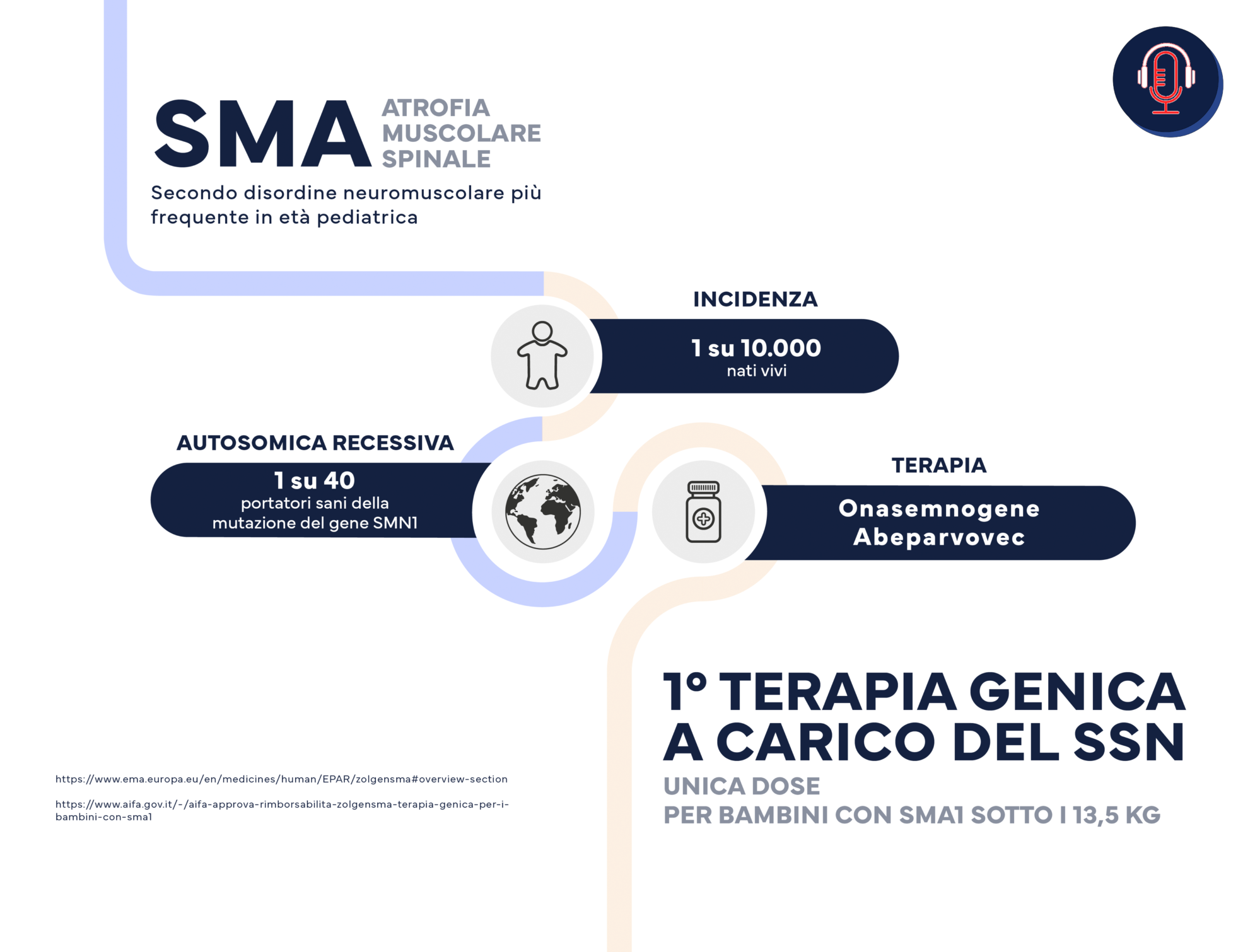
SMA
Si tratta di un grande passo per questa malattia genetica autosomica recessiva che ha un’incidenza di circa 1/10.000 nati vivi. In Italia, ogni anno, nascono circa 40-50 bambini con questo difetto genetico. Nella sua forma più grave, classificata come SMA1, la sopravvivenza in genere non supera l’anno dall’insorgenza dei sintomi. Le opzioni di cura fino a questo momento erano molto limitate per non dire inesistenti.
Il percorso approvativo
La Commissione Europea ha autorizzato onasemnogene abeparvovec all’immissione in commercio a maggio 2020.
L’AIFA ha seguito la scia europea dopo sei mesi, approvando la legge 648/1996 per il programma di accesso anticipato e pochi giorni fa, il 9 marzo per l’esattezza, ha concesso la somministrazione a carico del SSN per i pazienti entro 13,5 kg.
Inoltre, un accordo stipulato tra la società elvetica e AIFA consentirà all’azienda di mettere a disposizione gratuitamente Zolgesma per lo svolgimento di studi clinici su popolazioni di bambini di peso compreso tra i 13,5 e i 21 Kg. L’obiettivo di questo trial è quello di ottenere ulteriori dati relativi al profilo di sicurezza e di efficacia del prodotto in questa popolazione di piccoli pazienti.
Studio registrativo
Come riportato dal sito dell’EMA, uno studio principale ha mostrato che Zolgensma riduce la necessità di ventilazione artificiale nei bambini affetti da SMA.
- 20 dei 22 bambini cui era stato somministrato il farmaco erano vivi e respiravano senza ventilazione permanente dopo 14 mesi, mentre solitamente solo un quarto dei pazienti non trattati sopravvive senza la necessità di ventilazione.
- 14 dei 22 bambini che avevano ricevuto Zolgensma erano in grado di stare seduti per 30 secondi dopo 18 mesi, una tappa che non viene mai raggiunta nei bambini non trattati affetti da forme gravi della malattia.
- 1 bambino su 10 aveva riportato un aumento degli enzimi del fegato e vomito.
L’importanza dello screening neonatale
Come per tutte le terapie per la SMA, anche Zolgensma aumenta la sua efficacia quanto prima avviene la somministrazione. Per questo è di estrema importanza che lo screening neonatale diventi presto disponibile sull’intero territorio nazionale.
Lo screening neonatale è un’attività di sanità pubblica che ha come obiettivo la diagnosi precoce di alcune malattie congenite, tra cui la SMA. Al momento è stato proposto come studio pilota nel Lazio e in Puglia e l’obiettivo è quello di poterlo estendere lungo l’intero stivale.
Le terapie avanzate rivoluzionano il decorso della malattia
- Nusinersen, terapia su RNA (nome commerciale Spinraza), approvato da AIFA nel 2017.
- Risdiplam, terapia su RNA (nome commerciale Evrysdi), al vaglio dell’EMA in questi giorni, dopo aver ricevuto parere positivo dal CHMP. In Italia è disponibile dal 2020 grazie al programma di uso compassionevole.
- Onasemnogene abeparvovec, terapia genica (nome commerciale Zolgensma), appena approvato dall’AIFA.
Sitografia
https://www.ema.europa.eu/en/medicines/human/EPAR/zolgensma#overview-section
https://www.aifa.gov.it/-/aifa-approva-rimborsabilita-zolgensma-terapia-genica-per-i-bambini-con-sma1
https://www.ema.europa.eu/en/documents/product-information/spinraza-epar-product-information_it.pdf
https://www.ema.europa.eu/en/news/first-oral-treatment-spinal-muscular-atrophy-sma-recommended-approval
https://www.ema.europa.eu/en/documents/product-information/zolgensma-epar-product-information_en.pdf